本文的图像摘要
2021年1月31日 中国 成都
毕晓普癌症研究所(MBICR)近期发表的一篇文章揭示了通过筛选修饰子,来发现过量表达MYC癌蛋白的肿瘤的新靶点。这篇名为“The anti-apoptotic proteins Bcl-2 and Bcl-xL suppress Beclin 1/Atg6-mediated lethal autophagy in polyploid cells”的研究性文章于2020年5月27日发表在《Experimental Cell Research》杂志上。
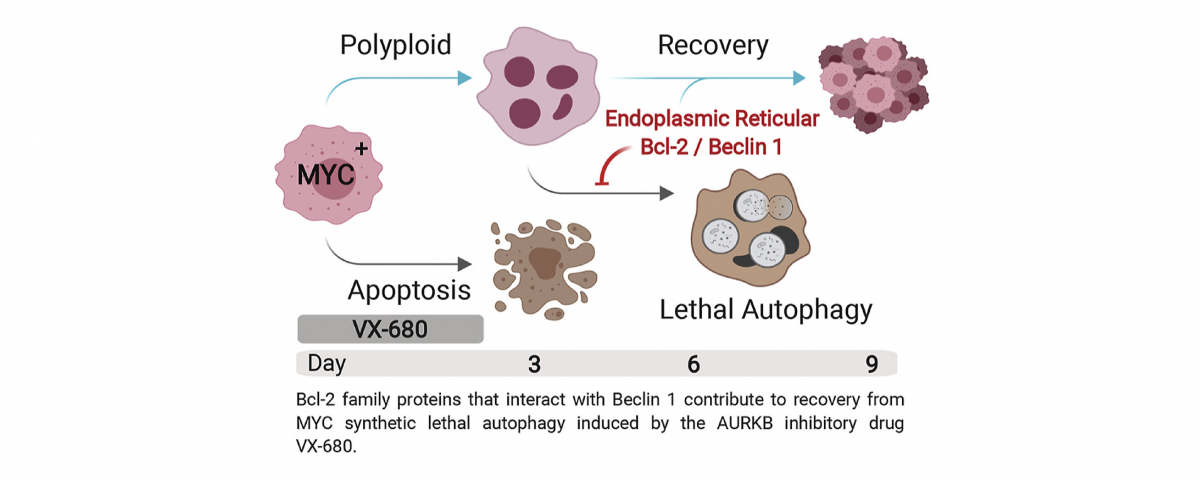
在副所长张晶博士的指导下,该研究课题是毕晓普癌症研究所、成都安泰康赛生物科技与成都中医药大学一次卓有成效的合作。该项研究是对MBICR所长杨顿博士与其恩师诺贝尔奖得主迈克尔.毕晓普教授的一项早期研究的延伸。当时他们发现了MYC癌蛋白过量表达与Aurora Kinase B的抑制之间的合成致死关系。随后,多个各自独立的研究组在各种人类恶性肿瘤里都验证这组合成致死关系。然而仍然未知的是那些在MYC过表达的癌细胞里高频发生的致癌改变,是否能调控这组合成致死关系。
因此,本文作者们专注于在一系列的等基因组细胞株里,测试潜在的修饰子。这些经过改造的细胞株能表达各种已知能引起化疗抗性的,或能够压制MYC引起的细胞凋亡的致癌因素,包括MyrAKT,PI3KE454K, ID1, p53DN, XIAP, BCl-2和 BCL-xL。很有意思的是,作者们发现只有抗细胞凋亡蛋白BCL-2和BCL-xL能够在MYC过表达细胞里,压制由Aurora Kinase的泛抑制剂VX-680Q引起的合成致死细胞死亡。
张晶博士解释道:“我们的研究表明,抗凋亡的BCL-2蛋白家族成员在这里起到的作用,并不是依靠其在线粒体里的抗细胞凋亡的活性,而是其在内质网通过与Beclin 1/Atg6蛋白相互作用,来降低细胞自噬造成的死亡,也就是MYC-VX680合成致死的细胞死亡的第二阶段。BCL-2和BCL-xL蛋白的抗细胞自噬活性,有选择性的在多倍体细胞而非二倍体细胞中,对MYC-VX680合成致死起到负调节的作用,并引发对AURKB靶向药物的耐药性”。
本文的共同作者Thaddeus Allen博士表示,AURKB这个靶点被VX-680成功的抑制住了,并且该抑制没有受到任何我们对细胞所做出的改变的影响。这很明显是因为所有的经过VX-680处理的细胞都发展成了多倍体细胞。由于BCL-2并不能抑制VX-680诱导的细胞凋亡,即MYC-VX-680合成致死的早期死亡,因此这些多倍体细胞死亡的机制,与已经大量报道过的在缺氧或生长因子缺乏的情况下,由MYC引发的细胞凋亡的机制是大有不同的。
MBICR所长杨顿博士,作为本文作者之一,说到:“这项研究不仅仅是发现了一种新的耐药性产生机制,更是指向了联合使用BCL-2抑制剂和AURKB抑制剂来治疗MYC过表达的肿瘤。更进一步来说,这项研究实现了产生一批同源性的多倍体细胞,用于多倍体合成致死剂的筛选。”
参与本项研究的人员,除了张晶博士,Thaddeus Allen博士和杨顿博士,还包括张申秋博士、石琼等研究所成员,以及成都中医药大学由凤鸣教授。若想获得关于该项研究的更多信息,请点此处参阅文章原文,或点此处查看相关报道。
欢迎在LinkedIn和Twitter上关注安泰康赛生物科技。
关于安泰康赛生物科技 —— https://www.anticancerbio.com/
安泰康赛生物科技(Anticancer Bioscience, ACB)是致力于将毕晓普癌症研究所的科学发现进行应用转化及商业化的国际化公司。ACB于2016年成立于中国成都,是建立在杨顿博士和他的诺贝尔奖得主导师迈克尔•毕晓普院士超过二十多年的研究合作基础之上。其创始团队是由探索合成致死精准癌症疗法的先驱和MYC生物学及细胞分裂等方面的专家组成。ACB已筹集超过2000万美元的资金,目前有近50名员工,分布在中国成都,印度海德拉巴,美国旧金山和英国圣安德鲁斯。